10月30日は、京都大学iPS細胞研究所・講師の中川誠人氏(化学1997)が、「iPS細胞の研究と将来展望」というテーマで講義を行いました。今回も、教室は満席、話題のiPS細胞がテーマということで、どうしても話しを聞きたいという学生たちが数多く押し寄せ、講義は熱気に満ちた状態で行われました。中川氏は「つくる」というテーマに基づき、体を「つくる」細胞について、iPS細胞を「つくる」こと、次代の再生医療を「つくる」こと、そして次代の研究者を「つくる」ということについて、講義を展開しました。
以下では、講義の内容をご紹介します。

----------------------------------------------------------------------
私たちの体をつくる細胞について
最初に自身の手の写真を見せながら、手にはどんな細胞があるか考えてみたことがあるでしょうか?と問いかけ、体をつくる細胞についての説明から話しを始めた。手には皮膚やツメがあり、手を動かす筋肉もある。それらはすべて細胞からできている。頭で考えて手を動かすわけだから、頭で考えたことを伝える神経細胞もある。手を太陽にかざすと血管が見え、その血管の中には血液が流れていてその血液の中にも様々な細胞がある。人間の体が多くの細胞からできていることをイメージしてほしい。
人間の体は260種類の60兆個の細胞からできている。細胞の大きさはおよそ10 μm(1 cmの1/1000の大きさ)であり、この細胞の中に核があってその中にDNAが存在する。DNAは生命をつくる設計図である遺伝情報だ。細胞が変化すれば人の人生も変わることがある。身長や髪の毛の色の違いといったものも元をただせば細胞の違いから生み出されている。また、細胞がガン細胞に変わればその人の人生はつらいものになることもある。しかし、iPS細胞を活用した新しい技術で、今まで治療できなかったガンを直すことができれば、その人の人生はまた明るいものとなる。バイオサイエンティストの究極の目的はヒト(の生命活動)を理解することであり、そのためには細胞を理解する必要がある。
iPS細胞をつくることについて
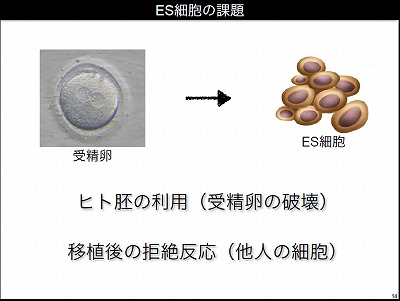
iPS細胞をつくることには、明確な目的があった。それはES細胞の課題を克服することである。iPS細胞はよく万能細胞と呼ばれるが、iPS細胞が登場するまではES細胞が臨床研究に応用できる万能細胞として期待されていた。まず、ES細胞の課題について説明するために、ES細胞とは何かを説明しよう。ヒトの受精卵が分裂して胚盤胞になった段階で、いろいろな体の部位に変化できる万能性を持った細胞のかたまりができてくる。この一部を採取して実験室で培養したものがES細胞である。
ES細胞は二つの特徴を持っている。一つはすべての細胞へ分化できる多様性である。もう一つは、ほぼ無限に増殖できる能力だ。この増殖能力はガン細胞に匹敵する能力である。ES細胞はヒトの体のほとんどの細胞になることが可能で、ケガや病気で失われた細胞の替わりを果たす細胞をつくることができるとして、再生医療に応用できることを期待されていた。たとえばパーキンソン病は脳の神経伝達物質であるドーパミンをつくる細胞が減っていく病気であるが、ドーパミンを作る神経細胞をES細胞からつくって移植することで治療ができるのではないかと考えられていた。また、脊髄損傷の患者にES細胞からつくった神経幹細胞を移植して治療することや、ES細胞からつくった心筋を移植することで心筋梗塞や心不全の治療ができるものと期待されていた。
しかし現状では臨床研究はほとんど行われていない。これは、ES細胞が二つの課題を抱えているからだ。一つ目の課題は倫理的な問題だ。ES細胞はヒトの受精卵からできるので、ES細胞をつくるには本来人間として生まれてくるはずであったヒトの受精卵を壊す必要が生じる(実際には不妊治療後の余剰胚を用いる)。こうしたことから、日本ではES細胞の利用については慎重である。もう一つの課題は、移植後の拒絶反応だ。ヒトの体にはバリヤーがあり、他人のES細胞からつくった細胞を移植すると受け付けず、患者の体には拒絶反応が生じて移植が成立しない。
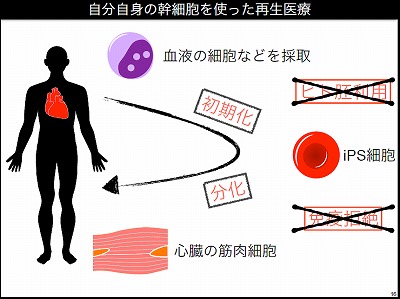
研究者たちは、自分の細胞から幹細胞をつくり、それを目的の細胞に分化させることができれば、倫理的な問題と拒絶(免疫反応)の課題を解決できると考えた。こうして生み出されたのがiPS細胞である。たとえば心臓病の患者に対して患者自身の心筋を採取し、それを増やして移植すればよいと考えるが、実際には心筋はあまり増殖させることができない。そこでほかの細胞、たとえば血液をとってきてそれを心筋にすればよいと思うが、血液を直接心筋にすることは現状では難しい。そこで血液の中の細胞を初期化して幹細胞を作製し、それを増殖させて今度は心筋に分化させることができれば有効ではないかと考えたわけだ。
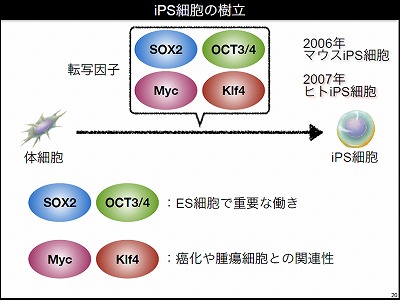
では、iPS細胞をつくるには、どのような方法が用いられているのだろうか。iPS細胞は、ヒトの血液などの体細胞からできている。ヒトの体細胞に、たった4つの転写因子を作用させるだけで、iPS細胞をつくることができる。山中研究室では2006年にマウスのiPS細胞の樹立に成功し、翌年にはヒトのiPS細胞をつくることに成功した。
まず、転写因子について説明しよう。セントラルドグマという言葉を聞いたことがあるだろうか。細胞の中に核があり、その中に遺伝情報であるDNAがある。DNAは細胞が分裂するたびに複製される。こうして、同じ遺伝情報が伝わっていく。このDNAからRNAというものができる。このステップのことを転写という。DNAの中にある遺伝子の情報を呼び出す作業にあたる。そして、RNAからタンパク質ができる。できたタンパク質が実際の細胞の中で働く物質となる。RNAというのは中間体であり、タンパク質をつくる情報となる。このRNAをつくることを制御しているものが転写因子である。遺伝子が働くかどうかのスイッチの、オン・オフ操作をしているのが転写因子であるといえる。
体細胞をiPS細胞につくり変える4つの転写因子とは、SOX2、OCT3/4、Myc、Klf4と呼ばれるものだ。SOX2とOCT3/4は、もともとES細胞において重要な役割を果たす転写因子として知られていた。また、MycとKlf4は癌化と関連性のある因子として知られていた。ガン細胞と同じように増殖性のあるiPS細胞の作製の際に、この因子が働いていたことは後から考えてみればリーズナブルであった。
次代の再生医療をつくることについて
ヒトのiPS細胞ができたことで次代の医療が進み始めている。iPS細胞技術応用の大きな方向性は二つある。一つは病態モデルをつくって新薬を探すという方向性だ。たとえば、パーキンソン病の患者の細胞をとってきてiPS細胞を作製するとしよう。パーキンソン病は、ある遺伝子の変異から起きることがわかっている(場合が多々ある)。当然、患者から採取した細胞にも遺伝子の異常が入っている。この細胞からiPS細胞をつくったとしても、その異常は残る。そしてこのiPS細胞からつくった神経細胞にもその異常は残る。つまり、その細胞は、試験管の中で患者の脳の中で起こっている病態を再現できるということになる。患者の頭の中から神経細胞をとってこなくても病態を再現できる。これを病態モデルと呼んでいる。病態モデルがあれば患者の体を使わず、試験管の中で新しい薬をつくる創薬のための実験や、薬の毒性を測る試験、副作用の試験などを行うことができる。
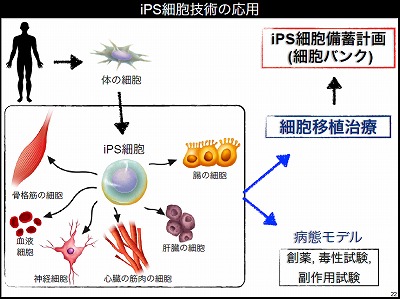
もう一つの方向性が細胞移植治療である。iPS細胞からいろいろな細胞をつくって、患者に移植し治療するというものだ。細胞の移植には、自家移植と他家移植という2種類の方法がある。自家移植は自分の細胞を移植する方法であり、他家移植は他人の細胞を移植する方法である。自家移植は自分の細胞を使うため、移植の際の拒絶反応はなく理想的ではあるが、iPS細胞をつくるために1年から2年の期間が必要となる。また大きなコストも必要となる。一方、ひとつのiPS細胞を様々な患者に使う他家移植は、凍結させた作製済みのiPS細胞を患者がすぐに使え、多くの人が利用することで単価が下がり、安価な費用で治療が行えるというメリットがある。iPS細胞を使った移植治療は、当面は他家移植が進んでいくであろう。
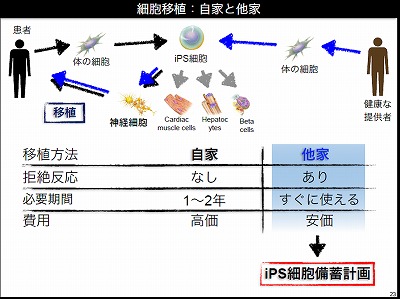
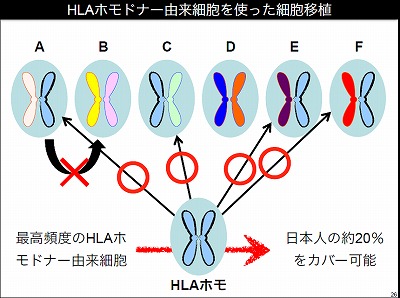
他家移植を進めるためにiPS研究所の中で、iPS細胞の備蓄計画を進めている。健常者から血液を採取してiPS細胞をつくり備蓄する計画だ。研究所の中に専用のクリーンルームを構築してこの計画を進めている。この備蓄計画のポイントは、他家移植による拒絶反応の問題を、解決することにある。iPS細胞の元となる細胞はHLAのホモドナーから提供してもらう。HLA(ヒト白血球抗原)とは人のほぼすべての細胞が持っているもので、免疫拒絶反応に深くかかわる因子だ。人は母親と父親からそれぞれHLAを受け継いでいる。母親と父親から偶然同じ型のHLAを受け継いだ人をホモドナーと呼ぶとする。HLAの型が違う人に細胞を移植すると拒絶反応が起こる。しかし二つのHLAうちどちらかのHLAの型が、同じHLAの型のホモドナーからの移植であれば、拒絶反応は起こらないと理論的に考えられる。日本人はHLAのタイプに偏りがあり、多くの人が持っているHLAの型がある。この最高頻度のHLAを持ったホモドナーからiPS細胞をつくれば、日本人の人口の約20%をカバーできる。iPS細胞研究所では日本赤十字社と協力してホモドナーを探している。ホモドナーがいれば色々な人へ移植ができ、他家移植が実現できると考えている。
さて、進み始めたiPS細胞技術の臨床応用であるが、その一層の進展のためには基盤技術の確立が重要である。我々の研究室では、臨床に使えるiPS細胞の培養方法について、研究を進めている。臨床に使える培養液(培地)と、基材(コーティング材)の開発が重要であり、この研究を進めてきた。現在、iPS細胞の培養をより簡単に行なうことのできる、新フィーダーフリー法と呼ばれる手法が開発されている。この手法では、ラミニンと呼ばれるヒトの体に多く含まれるタンパク質を、コーティング材に使用している(協力:大阪大学・関口教授、ニッピ)。また、培地にはStemFitという味の素と共同開発した培地を使用している。これにより、臨床応用可能なiPS細胞ができるようになってきている。作製したiPS細胞を様々な細胞に変化させる分化誘導の研究も進んでいる。iPS細胞研究所の中ではドーパミンを産生する神経細胞や、心筋細胞など様々な体の細胞が作れるようになっている。
再生医療の現状について少し説明しよう。先日、神戸理化学研究所の高橋政代先生が主導するプロジェクトの中で、目の病気を治療するために、iPS細胞からつくった細胞を移植する手術が行なわれた。世界で初めてのiPS細胞を活用した臨床応用だ。パーキンソン病、心臓病の治療、血小板の作製による献血に頼らない製剤の開発などの研究も日本で進んでいる。
米国のアドバンストセルテクノロジー社は、ヒトのES細胞から目の細胞をつくって移植する治療を十数例行って、大半で良好な結果を得ているようだ。臨床研究から一歩進んだ治験の段階に入っている。また同社は先日、ヒトiPS細胞由来の血小板製造に関する論文も発表しており、競争は激しくなってきている。
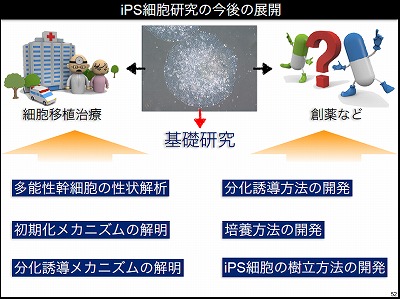
今後の展開は、説明してきたように細胞移植治療と創薬の2方向で、臨床応用が進んでいく。臨床応用を支えるのが基礎研究だ。iPS細胞の性状解析、初期化メカニズムの解明、分化誘導メカニズムの解析、培養方法の開発、iPS細胞樹立方法の開発などの研究が重要だ。iPS細胞研究所は、臨床研究を行う研究者と基礎研究を行う研究者が同じ建物の中にいて、効率的に研究が進んでいる。1日でも早く基礎を臨床に結び付けていきたいと考えている。
次代の研究者をつくることについて
中川氏は講義の途中で、次代の研究者をつくりたいというメッセージをこめて、ご自身の研究人生についてもコーヒーブレーク的に、話しをしました。
「私は、上智大学の4年生の時に生化学の研究室に入りたかったのですが、定員に対して希望者が多く、あみだくじにはずれて入ることができず、応用無機化学の研究室に入りました。そこでは、金属錯体のX線構造解析の研究をしていました。しかし、バイオサイエンスへの思いは断ちがたく、奈良先端技術大学院大学に進みました。そこで、研究(と人生)の師匠である貝淵弘三先生に出会い、貝淵先生の異動とともに名古屋大学に移り博士号をとりました。たまたま、貝淵先生が神戸大学における山中先生の先輩だったこともあり、貝淵先生の紹介で助手を探していた奈良先端大の山中先生の研究室に移ることとなりました。その後、山中先生とともに京都大学に移り、そこでiPS細胞ができて、今まで研究を続けることができました。やりたい研究ができて、世界で初めての発見ができる喜びを味わえることを本当にありがたいと感じています。山中研究室も最初は少人数だったのですが、研究の進展とともに徐々に人が多くなり、山中先生が2012年10月にノーベル賞を受賞して、いまでは5つの部門からなる300人規模の研究所となっています。そこで、私も独立研究者の一人として研究を行っています。いろいろな方々の協力のおかげで今の自分があります。研究を続けていく上では、人と人とのつながりが重要であると考えています。」

(以上)



-thumb-autox80-4503.jpg)


-thumb-autox80-4494.jpg)




